GMP/GLP强调“职责分离”(Segregation of Duties)。这意味着同一个人不能同时拥有创建样品、执行检测、审核结果、批准报告的全部权限。合格的LIMS必须支持细粒度的RBAC模型——通过“组织架构管理”模块定义部门、岗位,再为每个岗位绑定精确到功能按钮和数据字段的操作权限。例如:实验员可录入原始记录但不可修改他人数据;质量负责人可查看所有项目但不可直接干预检测过程。
某LIMS产品解决方案指出,其“组织架构管理”支持与钉钉/企业微信同步,并自动继承部门权限。当员工调岗时,系统自动回收旧权限、赋予新权限,无需IT手动调整。更重要的是,所有权限变更操作均被记录在审计日志中,包含操作人、时间、变更前后对比,满足GMP对“系统配置变更受控”的要求。
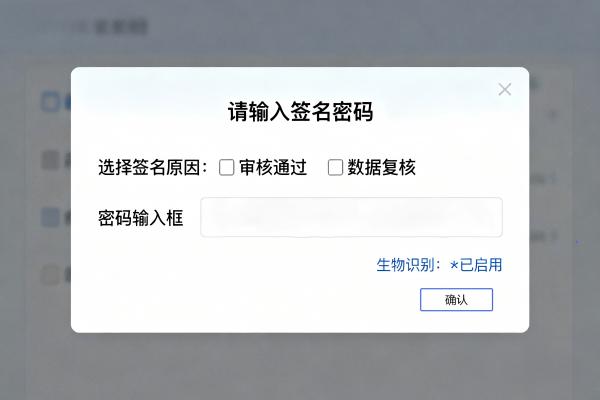
FDA 21 CFR Part 11 和 EU Annex 11 明确要求电子签名必须具备:唯一身份绑定、签名原因可选、防止签名后篡改。某LIMS产品解决方案内置的“电子签章”模块,强制要求用户输入独立密码或生物识别(如指纹)进行二次认证,并在签名时弹出“签名原因”下拉菜单(如“审核通过”“数据复核”),确保每次签名都有明确业务语境。
真正的合规签名不是附加在PDF上的图章,而是与原始记录、报告内容深度绑定的数字凭证。一旦签名完成,任何对关联数据的修改都会导致签名失效,并触发系统告警。参考《理化计量智慧管理平台操作说明书.docx》,壹博LIMS采用哈希算法对签名对象生成唯一指纹,确保“签一次,锁一生”.
某LIMS产品解决方案明确提供覆盖“任务分派→样品登记→原始记录→报告编制→电子签章”的全链路审计追踪。日志字段包括:操作人、时间戳、IP地址、设备ID、操作类型(新增/修改/删除)、修改前值、修改后值。即使管理员也无法删除或关闭审计功能,从根本上杜绝“数据黑箱”.
更进一步,系统还记录“谁在何时查询了审计日志”,形成对监督者的再监督。某华东地区大型CRO机构在FDA预审中,凭借LIMS提供的完整操作轨迹,成功解释了一次异常数据波动系仪器校准延迟所致,而非人为篡改,避免了重大合规风险.
在GMP/GLP的世界里,信任不是靠口头承诺,而是靠系统设计。权限管理划定责任边界,电子签名锁定行为意图,审计追踪还原事实真相——三者缺一不可。
正在了解 LIMS实验室信息管理系统 相关解决方案?
支持低代码定制开发、可源码交付与私有化部署,欢迎咨询!
咨询电话:15978966810
壹博LIMS在重庆本地的三大优势:贴近食品/环境/制造场景、2周敏捷定制、全周期本地服务团队,支持独立部署,助力实验室高效合规。
详细介绍LIMS在高危样品接收、存储、处理、废弃各环节的安全控制与追溯机制。通过权限隔离、环境联动、操作留痕,实现全流程闭环管理,保障人员与环境安全。附真实系统功能截图。
详解如何在10万元内通过可独立部署的定制LIMS,实现样品、检测、报告、审计追踪四大核心功能,附真实成本结构、选型避坑清单与CMA落地案例。
直接回应高搜索量疑问!本文提供2026年重庆地区LIMS系统透明化价格区间(10-50万+),并为中小企业、检测机构等不同客户提供精准选型建议与功能清单,助您找到最具性价比的解决方案。
企业选购LIMS常被价格差异困扰。本文深度解析部署方式、定制化、功能模块等5大核心定价因素,助你科学控本、精准选型。