
在迎接CNAS或CMA评审时,常有实验室自信地展示“我们有操作日志”,却在专家追问下哑口无言:
- 日志能否证明是谁在何时修改了关键结果?
- 能否还原修改前后的具体数值?
- 日志本身是否可能被管理员删除或关闭?
这些问题直指一个核心事实:普通“日志” ≠ 合规“审计追踪”。
真正的审计追踪,不是可选项,而是LIMS作为受控系统的基石,必须满足ALCOA+原则,并具备法律证据效力。
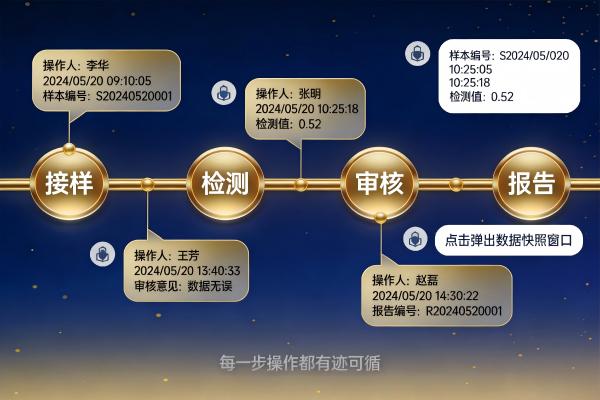
合规的LIMS应将审计追踪设为系统级强制功能:
- 无需手动启用,所有关键数据操作自动记录;
- 管理员无权关闭或暂停该功能;
- 即使系统异常重启,日志写入机制仍保持原子性,避免丢失。
这是CNAS-CL01:2018 第7.11条的隐含前提:追踪机制必须持续有效。
审计日志本身必须具备防伪能力:
- 采用只读存储(如WORM存储或数据库审计表);
- 每条记录包含时间戳、操作者ID、IP地址、会话令牌;
- 通过哈希链(Hash Chain) 技术确保任何篡改都会破坏后续记录完整性;
- 导出日志自带数字签名,可验证真伪。
FDA 21 CFR Part 11 明确要求:“审计追踪必须以安全方式保存,防止被修改或删除。”
合格的审计追踪需记录具体字段的前后值,而非笼统的“修改了记录”:
- 例如:将“检测结果”从 12.3 mg/L 改为 12.5 mg/L,日志需明确显示旧值、新值、修改原因(若强制填写);
- 对于批量操作(如整批样品复测),需逐条记录每一样品的变更;
- 删除操作需记录被删内容快照,而非仅标记“已删除”。
这是实现“可追溯性”和“责任界定”的关键,也是ALCOA+中“准确性”与“完整性”的体现。
最高级的审计追踪支持操作上下文还原:
- 点击某条日志,可直接跳转至当时的数据视图(即使当前数据已被覆盖);
- 支持按时间轴重建某样品从接样到报告的完整操作链;
- 可导出带时间戳的PDF审计包,供评审专家现场查验。
某医疗器械检测机构凭借此功能,在FDA现场检查中10分钟内完成全部数据溯源,赢得高度认可。
审计追踪的本质,不是监控员工,而是为数据赋予可信度。
当LIMS的审计追踪真正满足“不可关闭、不可篡改、精确记录、上下文可还原”四大标准,实验室便拥有了应对任何审计的底气——因为每一份数据,都有其不可抵赖的“数字足迹”。
在合规时代,看不见的追踪,才是最强大的保障。
正在了解 LIMS实验室信息管理系统 相关解决方案?
支持低代码定制开发、可源码交付与私有化部署,欢迎咨询!
咨询电话:15978966810
详解FDA 21 CFR Part 11对电子记录的核心要求,并展示壹博LIMS如何通过不可篡改审计追踪、双因子电子签名、完整系统验证等能力,助力中国实验室顺利通过FDA审计,开拓美国市场。
壹博LIMS通过RBAC权限模型、字段级隔离、全操作审计与会话安全机制,构建多层防护体系,确保检测数据不被越权访问、篡改或泄露,满足CNAS与等保要求。
详解LIMS系统通过唯一编码、批次绑定、效期预警与使用记录联动,实现试剂、标准品等耗材的全流程可追溯管理,满足CNAS/GLP合规要求,杜绝过期使用与浪费。
详解LIMS如何通过身份认证、自动时间戳、原始数据锁定、完整操作日志等技术,全面满足ALCOA+九大原则,助力实验室通过FDA、CNAS等严苛审计。
LIMS系统怎么选?流程管理有哪些不足?”免费获取壹博LIMS落地方案,覆盖原始记录、报告生成、设备人员管理,满足CNAS认可要求,重庆本地化服务支持。