标物信息是LIMS实验室信息管理系统中标物管理模块的主数据核心,承载着每一种标准物质(Reference Material, RM)或有证标准物质(CRM)的完整身份档案。高质量的标物信息不仅是实现精准领用、有效核查、合规追溯的基础,更是确保检测结果具备计量溯源性、满足CMA/CNAS评审要求的关键前提。重庆壹博LIMS通过结构化建模与智能关联机制,对标物信息实施标准化、集中化、可审计的全生命周期管理。
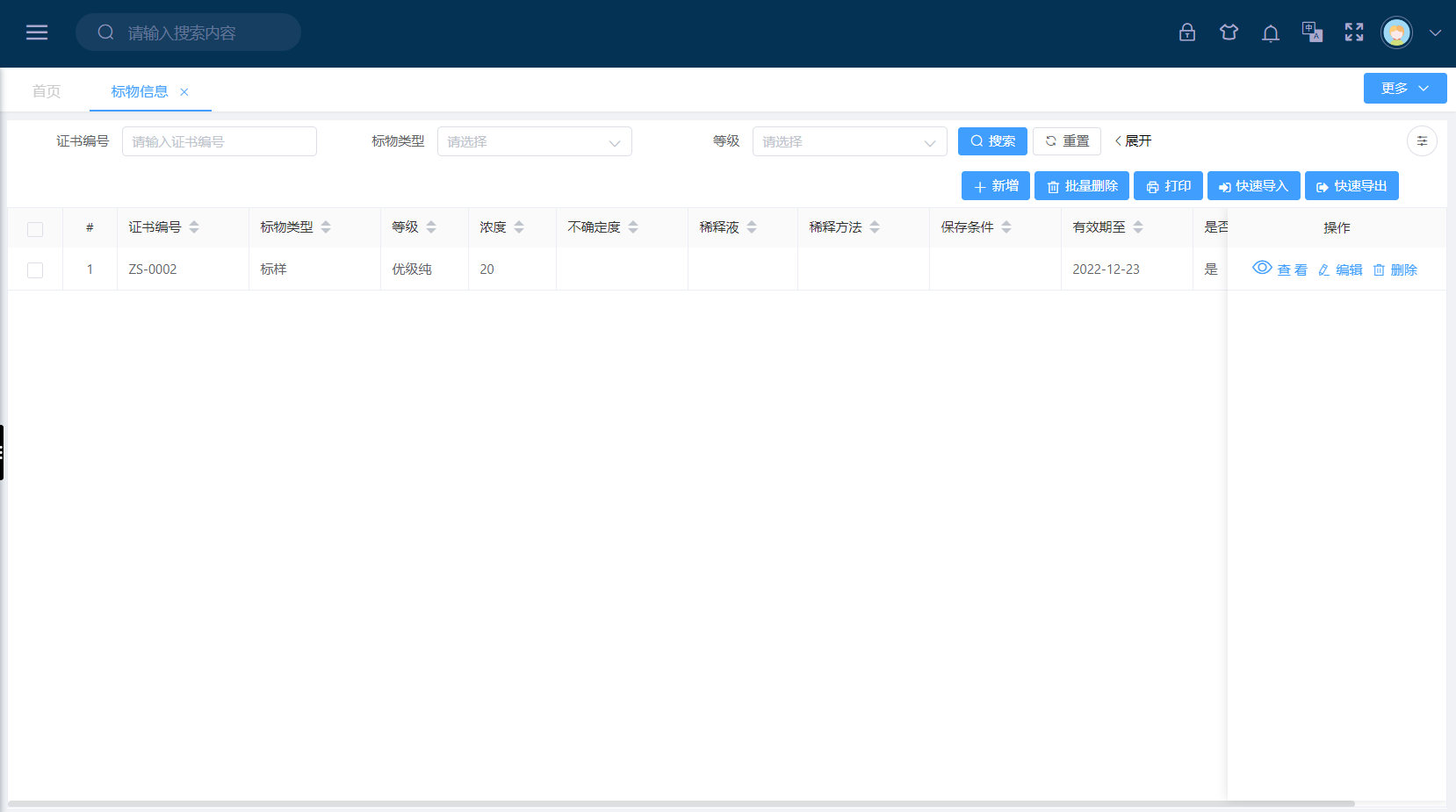
LIMS标物信息模块支持维护以下核心属性:
• 基础标识:标物编号(唯一ID)、中文名称、英文名称、别名
• 认证信息:证书编号、生产厂商、CRM编号(如GBW、NIST)、认定值及扩展不确定度
• 技术参数:基体类型(水、土壤、血液等)、目标组分、浓度/含量、均匀性与稳定性说明
• 有效期管理:启用日期、失效日期、开封后有效期(如适用)
• 存储条件:温度范围(如2~8℃)、避光、干燥等要求
• 溯源链:上一级标准物质编号或国家基准信息
• 状态控制:当前状态(待验收、合格、停用、报废)
所有字段均支持附件上传(如电子版证书PDF),确保原始证据可查。
标物信息是执行期间核查和自配标液标定的数据依据。当系统触发某标物的核查计划时,自动调取其认定值与不确定度作为判断基准;在标液配制过程中,LIMS根据母液标物的浓度、纯度及稀释倍数,自动计算新标液的理论浓度,并生成带审核流程的标定记录。若标物信息缺失或错误,将直接导致质控失效。
CNAS-CL01:2018 第7.8.1.3 条要求:“当使用标准物质进行校准或质量控制时,应记录其识别信息。”LIMS在生成检测报告时,可自动关联所用标物的编号、批号、证书编号及有效状态。评审专家可一键追溯该标物从采购到使用的全过程,验证其是否在有效期内、是否经过期间核查、是否来自认可机构——这正是高质量报告不可或缺的溯源证据链。
标物信息并非孤立存在,而是贯穿LIMS标物管理全流程:
• 申购阶段:引用历史标物信息快速创建采购需求;
• 验收阶段:比对到货标物证书与系统预录信息是否一致;
• 领用阶段:仅允许领取“状态为合格”且未过期的标物;
• 核查阶段:自动提醒临期核查,并记录实测值与认定值偏差;
• 报废阶段:停用后仍保留历史信息,确保过往检测记录可解释。
这种深度集成确保标物始终处于受控状态。
不同实验室对标物分类需求各异。环境实验室关注水质、大气、土壤标样;食品实验室侧重农残、重金属、添加剂标准品;制药QC则需管理药典对照品。LIMS支持按“领域-基体-组分”建立多级分类体系,并允许为不同类别预设专属字段模板(如“基体回收率要求”“药典版本”),实现灵活适配。
随着法规更新或业务拓展,标物信息模型可能需要调整。LIMS采用低代码架构,管理员可随时新增自定义字段(如“ISO 17034认证状态”“生物安全等级”),或调整必填规则,无需开发介入。所有变更自动记录至系统日志,确保主数据治理过程透明、可审计。
正在了解 LIMS实验室信息管理系统 相关解决方案?
支持低代码定制开发、可源码交付与私有化部署,欢迎咨询!
咨询电话:15978966810
详解评估LIMS ROI的5大可量化维度:人力效率、报告周期、合规风险、数据价值、业务增长。提供计算公式与行业基准,助您科学测算LIMS投入产出比。
详解LIMS上线前必须完成的5项数据准备工作:主数据界定、编码统一、无效数据清理、非结构化数据转化、字段映射校验,避免因“脏数据”导致系统失效、报表失真、审计不通过。
详解FDA 21 CFR Part 11对电子记录的核心要求,并展示壹博LIMS如何通过不可篡改审计追踪、双因子电子签名、完整系统验证等能力,助力中国实验室顺利通过FDA审计,开拓美国市场。
详解壹博LIMS如何利用机器学习分析历史检测数据,智能识别异常、推荐验证参数、自动计算精密度与检出限,大幅缩短方法验证周期,满足ISO/IEC 17025与CNAS合规要求。
详解LIMS与CRM集成如何通过统一客户视图、自动任务触发、结果回传与回款同步,实现检测业务从线索到回款的端到端闭环,提升客户满意度与资金周转效率。